Applikationsexperiment
– vad är det för metall?
I
applikationsexperimentet skulle vi bestämma vilken metall ett okänt föremål
bestod av med hänsyn till de slutsatser som vi dragit i våra tidigare observationer
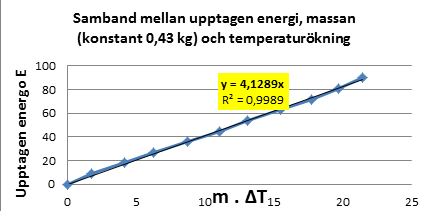
och testexperiment: ”För att åstadkomma temperaturändringen ΔT hos massan m av
ett ämne, måste energin E tillföras eller avges (E= c . m. ΔT) och ämnets
specifika värmekapacitet c är den energi som upptas eller avges då temperaturen
hos 1 kg av ämnet ändras 1ºC ”. För att
lösa problemet använde vi oss av olika fysiska ansatser och vi utförde två olika
metoder för att samla termiska data för den okända metallen:
Metod 1-
Undersöka metallens specifika
värmekapacitet
Metod 2-
Undersöka metallens Densitet
Metod 1 -
Problemlösning genom undersökning av metallens Speciella värmekapacitet
Teori: För att åstadkomma temperaturändringen ΔT
hos massan m av ett ämne, måste energin E tillföras eller avges (E= c . m. ΔT). Ämnets specifika
värmekapacitet c är den energi som upptas eller avges då temperaturen hos 1 kg
av ämnet ändras 1ºC ”.
Utförande av
metod 1:
För att ta
reda på vad för slags metall den fasta ämnen är, började vi att bestämma metallens
specifika värmekapacitet c. I en termosflaska liknande kärl med c= 70 J/k (vi utgår från en standard kärl) fyllde
vi i 200 g vatten , rörde om och mätte sedan temperaturen 14ºC i vattnet. Sedan
värmdes upp den 204 gram metallen i ett kärl med kokande 100ºC vatten och sedan
stoppade vi snabbt ner den 99ºC värmda metallen i den 200 gram 14ºC vattnet i termosen
och rörde om igen. Sluttemperaturen
uppnått 20,14ºC.
Resultat av metod 1:
Vatten
|
metall
| |||
m vatten=
|
200 g
|
m metall=
|
204 g
| |
T0 vatten=
|
14 ºC
|
T0 metall =
|
99 ºC
| |
sluttemperatur
|
20,14 ºC
|
sluttemperatur
|
20,14ºC
| |
Δt vatten =
|
6,4 ºC
|
Δt metall =
|
79 ºC
|
 |
| bild 1 visar uppvärmning av metallen |
Analys av
metod 1:
Vi kunde ha räknat
ut värdet (beloppet) på metallens specifika värmekapacitet C genom följande
teori, samband och formler:
Q vatten =
C vatten x m
vatten . ΔT
vatten
|
Q metall =
C metall x m
metall . ΔTmetall
|
Enligt
termodynamikens huvudsats, kan energi varken skapas eller förstöras utan endast
omvandlas.
Energi principen:
|
E upptagen = E avgiven
|
När metallen
har avgivit lika mycket inre energi som vattnet har tagit upp, sjunker
temperaturen i metallen mycket mer än den ökar i vattnet.
Termosen och vattnet
tar emot värmen Q1 = ( C + cm) ΔT.
Metallen
avger värmen Q2 = cm ΔT2
Om vi bortser
från värmeförlusterna till omgivningen, får vi enligt energi principerna:
Q1
= Q2
C metall
=
|
C
vatten . m vattem. Δt vatten
|
m metall . Δt metall
|
( ctermos+ Cvatten . mvatten) ΔTvatten = Cmetall.mmetall . ΔTmetall
(70 + 4190 . 0.200) ( 21 – 14 ) = C . 0.204
(100 – 21)
908 . 6.14 = C . 0.204 . 78,4
5575,12 = C . 15,993
C = 348,59 g/cm3 , C = 0.35
J/kg.K
Vårt resultat
från metod 1 visar värdet på metallens specifika värmekapacitet som C = 0.35 J/ kg. K. Om vi jämför detta
resultat med data från densitetstabellen så ser vi att närmaste värde är specifik
värmekapacitet för ämnet mässing ä: c mässing = 0,38 J/kg. K
Metod 2 - Problemlösning genom undersökning av
metallens Densitetens värde (belopp)
Vi har utfört
följande metod med hänsyn till den experimentella osäkerheten vi hade i den första
metoden.
 |
| Bild 2 visar metallen storlek |
Teori: Densitet, eller tätheten hos ett material är ett mått på hur tätt materialet är packad. För att räkna ut metallens densitet kan vi använda oss av formeln:
Densitet=massa
/volym
|
P= m/V
|
Densitet betecknas
med p och enheten SI är kg/m3 eller g/cm3. Sambandet
mellan de enheterna är 1kg/m3 = 10-3g/cm3
Utförande och
resultat av metod 2:
För att räkna
ut densiteten krävdes det att räkna ut metallens volym.
Volymen av
cylindern kan räknas från formen:
V= h x b
V = 7,7 x
3,14 = 24,178 cm3
Vi vet också
att metallens massa är 204 gram. För att då räkna ut densiteten använde vi densitets
formel:
P= m/V, den ger: P
= 204 g/24,178 cm3
P= 8,437 g/cm3
Analys av
metod 2:
Densitet, eller
tätheten, hos ett material är ett mått på hur tätt materialen är packad. Den
betecknas med p och enheten SI enheten är kg/m3 eller g/cm3.
Samma volym av två olika metaller har två olika massor eftersom en av dem
förpackningar fler atomer i samma utrymme än den andra.
Vårt resultat
utav metod 2 visar en densitet med värde på P= 8,43 g/cm3.
Om vi jämför resultatet med data från densitetstabellen så ser vi att
densitetsvärden för ämnet mässing är 8,4
g/cm3.
Slutsats och analys av applikationsexperimentet
metod 1 och metod 2:
Syftet med val av olika metoder i experimentet var att metoderna ska lösa problemet, Vad är det för metall? och kan med hög sannolikhet leder till en tillbörlig lösning.
Applikationsexperimentets resultat
|
|
Metallens specifika värmekapacitet:
|
C = 0.35 J/ kg
|
Metallens densitet:
|
P= 8,4 g/cm3
|
Information från Termiska
tabellen:
|
|
Mässings specifika värmekapacitet:
|
C = 0.38 J/ kg
|
Mässings densitet:
|
P= 8,4 g/cm3
|
Som
slutresultat fick vi fram att den okända metallen var mässing. Det fanns
skillnader mellan de två metoderna och det visas också i resultatet. I första metoden mötte vi en rad olika anledningar
och felkällor till att varför vi fick fram 0,03 J/kg lägre specifik
värmekapacitet för mässing, däremot den andra metoden var mindre beroende av
omgivningen och energin med mindre orsaker till osäkerheten. Resultat från
första metoden d.v.s. undersökning av metallens specifika värmekapacitet visar
en differens på 0,03 J/kg ( 0,38 – 0,35 = 0,03) enheter. Vilket tyder på
eventuella felkällor. Men den andra metoden d.v.s. undersökning av metallens
densitet visar mycket mindre skillnad i värden. Vilket beror på visa
avrundningar i beräkningarna av densiteten. Termiska tabellen visade det
avrundade värdet för mässings densitet, om vi avrunda vårt värde, blir densiteten
också 8,4 g/cm3.
Felkällor: Det finns en rad olika anledningar till att
varför vi fick fram 0,03 J/kg lägre specifik värmekapacitet för mässing.
-Termosen värms
upp och förlorar värme till omgivningen
-Det går värme
ut ur termosen,
-Lite
kokhetvatten följer med metallvikten.
-Vikten kylar
ner när vi lyfter metallen genom luften
-Metallen
svalnar i vägen från uppvärmning till termosen
Fel på
mättning av vattenmängd, eventuella fel på värmemätningar, vissa avrundningar
av siffror i beräkningar o.s.v.
Förslag till förbättrings: Det skulle behövas mer utav experimentet var om
vi hade värmt upp metallen i flera olika temperaturer så att vi hade kunde
kunnat göra ett diagram över hur energin upptas och avges så att resultatet
kunde vara mer realistisk. Temperaturen kan även ha blivit lite felaktig för
att vi inte rörde om vattnet lika mycket hela tiden, ett förbättringsförslag är
att vi ska röra om vattnet noggrant hela tiden för att temperaturen i termometern
stämmer överens med temperaturen i det övriga vatten vid avläsningen på
termometern. Ett annat förbättringsförslag är att vi kunde jämföra våra resultat
med andra grupper som hade samma ämne för att kunna jämföra och utvärdera våra
olika arbetsmodeller i utförande av applikationsexperimentet
Slutsats: I applikationsexperimentet har vi
kommit fram till att den okända metallen bestod av mässing om vi bortser från
eventuella felkällor.