1-Observationsexperiment om vattnets specifika värmekapacitet
Inledning: Atomerna i materialen har både rörelseenergi och potential
energi. Summan av den inre rörelseenergin och den potentiella energin är den
inre energin. Inre energi kallas ofta värmeenergi eller termisk energi. När vi
värmer vatten så ökar vattnets inre energi och samtidigt stiger temperaturen.
Temperaturen hos ett ämne ökar om den genomsnittliga rörelseenergin i ämnets
molekyler ökar. Detsamma gäller om rörelseenergin minskar, då minskar även
temperaturen.Ett ämnes specifika värmekapacitet(c) är det som anger den energimängd
som behövs för att höja temperaturen hos 1 kg vatten 1 grad.
Syfte:
Syftet med experimentet handlar om att undersöka om det finns ett samband mellan tillförd energi (E) och temperaturändringen (ΔT). Till exempel hur temperaturen hos vattnet ändras när den inre energi ökar. Syftet är att genomföra ett observationsexperiment och söka ett mönster och samband mellan E och ΔT.
Material, genomförande och resultat:
Syftet med experimentet handlar om att undersöka om det finns ett samband mellan tillförd energi (E) och temperaturändringen (ΔT). Till exempel hur temperaturen hos vattnet ändras när den inre energi ökar. Syftet är att genomföra ett observationsexperiment och söka ett mönster och samband mellan E och ΔT.
Planering av experiment
Dagens observationsexperiment handlar om att undersöka vattnets
specifika värmekapacitet. För att hitta svar krävs det att man hittar sambandet
mellan upptaget energin (E), vattnets massa(m) och temperaturförändringen (Δt) hos
vattnet. För att undersöka sambandet bestämmer vi att samla data och
analysera den genom att för det första, värma upp 400 g (0,4 kg) vatten och därefter
mäta de temperaturökningar ΔT som olika kopplingstider ger upphov till och
hitta ett samband mellan variabel. I nästa steg skulle vi variera vattenmängden
och mäta den energi som krävs för en och samma temperaturökning (ΔT= 5) och
hitta ett samband. Sedan skall vi sammanfatta de två sambanden i ett nytt
samband. Med hjälp av tabeller och
grafer ska vi hitta ett mönster i mätresultatet.
Material, genomförande och resultat:
Material:Termos, vatten,
våg, doppvärmare, digital termometer och klocka. Mätningarna genomfördes med hjälp av den digitala termometern. För att värma vattnet använde vi en doppvärmare P = 300 W (en watt motsvarar en
energiomvandling på en joule per sekund eller P=J/s ). Genom att mäta temperaturen varje 30 sekund då doppvärmaren är inkopplad, kunde vi beräkna energimängden E (SI-
grundenheten för energi är joule J) som tillförts vattnet och ökat dess inre
energi. E = P. t
Uppvärmningen sker i en termosflaska för att så litet energi som möjligt ska förloras till omgivningen.
Uppvärmningen sker i en termosflaska för att så litet energi som möjligt ska förloras till omgivningen.
1-m är konstant
- För det första så värmde vi 400 g (0,4 kg) vatten och vi mätte upp de temperaturökningar ΔT
som olika kopplingstider gav upphov till. Vi gjorde tabell och diagram i Excel
och har noga undersökt vilket samband kunde finnas mellan den tillförda energin
och temperaturökningen när mängden vatten hålls konstant.
Tabell
A) Samband mellan tid och temperatur när massan är konstant:
tid (s)
|
temperatur(°C)
|
0
|
20,8
|
30
|
24
|
60
|
29,6
|
90
|
34,6
|
120
|
40,3
|
150
|
45,7
|
180
|
50,4
|
210
|
56
|
240
|
61,2
|
270
|
65,7
|
300
|
69,9
|
Diagram
1) Samband mellan tid och temperatur när massan är konstant 0,4 kg
Tabell
B) Samband mellan den tillförda energin och temperatur ökning när massan är
konstant:
ΔT (°C)
|
E (kJ)
|
0
|
0
|
4
|
9
|
9,6
|
18
|
14,6
|
27
|
20,3
|
36
|
25,7
|
45
|
30,4
|
54
|
36
|
63
|
41,2
|
72
|
45,7
|
81
|
49,9
|
90
|
Diagram
2) Samband mellan den tillförda energin och temperatur ökning när m är konstant
Resultat
1: Vi kunde se från grafen att den tillförda energin är proportionell mot
temperaturökningen när m är konstant (rät linje Y=kx)
2-
ΔT är konstant-
I nästa steg varierade vi vattenmängderna 300 g, 400g, 500g, 600 g, 700g och mätte vi den energi som krävs för en och samma temperaturökning ΔT= 5°. Vi gjorde en tabell och diagram i Excel och undersökte utav de, ett samband mellan den tillförda energin och mängden vatten när temperaturökningen hålls konstant.
I nästa steg varierade vi vattenmängderna 300 g, 400g, 500g, 600 g, 700g och mätte vi den energi som krävs för en och samma temperaturökning ΔT= 5°. Vi gjorde en tabell och diagram i Excel och undersökte utav de, ett samband mellan den tillförda energin och mängden vatten när temperaturökningen hålls konstant.
ΔT = konstant
Tabell
C) samband mellan tid och massa när ΔT är konstant:
m (kg)
|
tid (s)
|
0,3
|
22
|
0,4
|
30
|
0,5
|
43
|
0,6
|
44
|
0,7
|
50
|
Diagram
3) Samband mellan tid och temperaturändring när ΔT är 5 grader
Tabell
D) Samband mellan den tillförda energin och mängden vatten när ΔT är konstant:
m (kg)
|
Energi (kJ)= p.t
|
0,3
|
6,6
|
0,4
|
9
|
0,5
|
12,9
|
0,6
|
13,2
|
0,7
|
15
|
Diagram
4) Samband mellan den tillförda energin och mängden vatten när ΔT är 5 grader
Resultat
2: Vi kunde se från grafen att den energi som krävdes för en och samma
temperaturökning ΔT= 5 grader är också proportionell mot vattens massa m.(Y=kx)
3-
De två proportionaliteterna kan sammanfattas i följande samband mellan upptagna
energin E, vattnets massa m och temperaturökningen ΔT
E
= c . m ΔT
Upptagen
energi(j) =konstant. Massa (KG).temperaturökning
Konstant
c kallas vattnets specifika värmekapacitet och anger den energimängd som behövs
för att höja temperaturen hos 1 kg vatten 1 grad.
Tabell
E) samband mellan Upptagen energi, massan (konstant) och temperaturökning:
m (kg) ΔT
(°C) m. ΔT E (kJ)
0,43 0 0 0
0,43 4 1,72 9
0,43 9,6 4,128 18
0,43 14,6 6,278 27
0,43 20,3 8,729 36
0,43 25,7 11,051 45
0,43 30,4 13,072 54
0,43 36 15,48 63
0,43 41,2 17,716 72
0,43 45,7 19,651 81
0,43 49,9 21,457 90
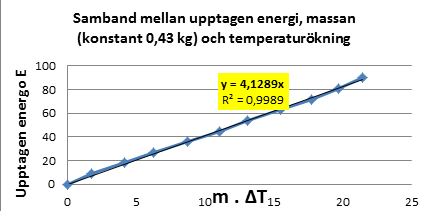
Diagram 5) Samband mellan upptagen energi,
massan (0,43 kg) och temperaturökning
Resultat 3: C = E/(m. ΔT), C = 4,12 J/Kg . grad |
Vattens
specifika värmekapacitet = 4,12 J/kg . grad
|
Tabell
F) Samband mellan Upptagen energi, massan och konstant temperaturökning:
m (kg)
|
ΔT (°C)
|
m. ΔT
|
Energi (kJ)
|
0
|
5
|
0
|
0
|
0,3
|
5
|
1,5
|
6,6
|
0,4
|
5
|
2
|
9
|
0,5
|
5
|
2,5
|
12,4
|
0,6
|
5
|
3
|
13,2
|
0,7
|
5
|
3,5
|
15
|
Diagram
6) Samband mellan upptagen energi, massan och konstant ΔT= 5 °C
C
= E/(m. ΔT) , C = 4,47 J/Kg
Resultat 4: C = E/(m. ΔT), C = 4,47 J/Kg. grad
Vattens
specifika värmekapacitet = 4,47 J/kg. grad
Analys: När vi sammanställer och jämför resultatet av de två proportionaliteterna från
första experimentet där mängden vatten hålls konstant m = 0.43 kg resultatet
visar att vattens specifika värmekapacitet är c = 4,12 J/kg. grad men i andra
experiment när temperaturökningen är konstant ΔT= 5 °C blev resultatet blir att vattnets specifika värmekapacitet är 4,47 J/kg. grad. Resultatet från det första experimentet stämmer
ganska bra med vattens noggranna värmekapacitet på 4,19 J/kg. grad men i andra försöket
där vi varierade mängden av vatten uppstod ett resultat på c = 4,47 J/kg. grad,
vilket tillförde mer energi. Vårt resultat är ganska rimligt med genomsnittet:
4,12 + 4,47=8,59/2 = 4,29 J/kg . grad men
eftersom den tillförda energin inte bara användes inte bara för att värma upp vattnet. Utan det finns eventuella felkällor såsom värme förs istället till doppvärmaren, digital
termometern och termosflaskan eller fel mätning av tiden. Därför kunde vi inte uppnå ett noggrant värde för
att uppnå vattens specifika värmekapacitet på 4,19 kJ (kg. grad).
Slutsats: Vi har kommit fram att sambandet E=